啟動成功關鍵,隨時掌握商周.com最新資訊
提供第一手新聞解析、財經趨勢、專屬活動
啟動成功關鍵,隨時掌握商周.com最新資訊
提供第一手新聞解析、財經趨勢、專屬活動
肝硬化是一種難以治癒的病症,全球據說有600萬名患者。最新的醫療技術正在開拓新藥開發之路,而挑戰新藥開發的是材料廠商和研究員兼醫生的組合。
肝硬化是難以根治「頑疾」之一,主要由B型、C型肝炎病毒,或酒精等長期損害肝細胞而導致的慢性肝病。
罹患肝硬化後,會出現乏力、食欲不振、低燒、腹部積水及黃疸等症狀,還有可能出現肝臟血液循環障礙,出現靜脈瘤並破裂等危險。並且,肝硬化發展成肝癌的機率很高。在日本,每年有4萬多人因患肝硬化等肝病而死亡。
目前還沒有根治肝硬化的有效方法。雖有利用抗病毒藥物抑制肝炎病毒繁殖的方法,但肝炎患者中仍有30~50%會發展成肝硬化。另外也有通過控制炎症,在肝臟硬化之後仍維持肝功能的方法,但這只是對症療法,日本等國家都期待開發出能根治肝硬化的藥物和治療方法

能滿足這種期待的治療藥物有望在日本誕生。從事開發的是日本札幌醫科大學研究分子標靶治療的特聘教授新津洋司郎和製造半導體相關材料及光學薄膜等的日東電工。日東電工執行董事丸山景資表示,「將於2018年投產治療藥物,希望能給肝硬化患者帶來福音」。
精確運載藥物
日本札幌醫科大學的新津教授在肝硬化研究中的著眼點是「肝星狀細胞」這一星形組織。
肝星狀細胞分泌的膠原蛋白會引起肝硬化。當肝細胞被肝炎病毒或酒精等損傷時,位於毛細血管和肝細胞之間的肝星狀細胞就會被激活,合成大量的纖維狀膠原蛋白以修復損傷。膠原蛋白是蛋白質的一種,是細胞再生不可缺少的成分,但炎症長期存在時,肝星狀細胞就會失控,無休止地合成膠原蛋白。結果,肝臟佈滿膠原蛋白纖維,變得坑坑洞洞且堅硬,毛細血管向肝細胞供血不暢,導致肝功能下降,在肝臟內迂迴的血液形成靜脈瘤。
因此,研究人員設想用藥物抑制肝星狀細胞過度合成膠原蛋白。如果能讓肝星狀細胞停止合成膠原蛋白,肝臟就會恢復原本很強的自我修復能力,「也可能根治肝硬化」。

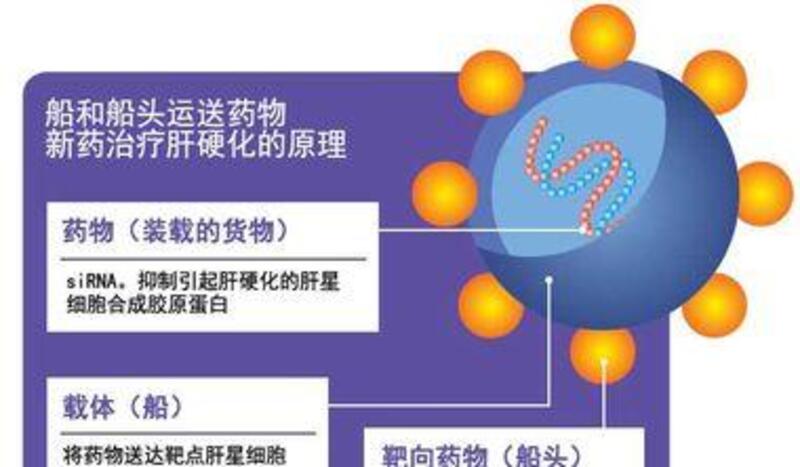
治療肝硬化的原理
為治療肝臟內出現的炎症,肝星狀細胞過度合成膠原蛋白,從而引起肝硬化。因此使用高效輸送藥物的機制(給藥系統)和與基因具有相似構造的藥物(核酸藥物)來抑制膠原蛋白合成。
不過,要想利用這一方法,需要解決兩大課題。一是如何製造抑制肝星狀細胞合成膠原蛋白的藥物。二是如何將這種藥物準確送達肝星狀細胞。
關於第一個課題,新津教授最終採用了「核酸藥物」,利用siRNA(小干擾核糖核酸)這種與細胞內的DNA擁有相似構造的成分,對細胞內生成膠原蛋白的mRNA(信使核糖核酸)進行分解。
siRNA易溶于血液,因此,不使用載體的話,就算能將其送入血管,也難以到達肝臟發揮作用。
要解決這一課題,就必須採用能將藥物準確送達靶組織的給藥系統(DDS)。
於是,新津教授和日東電工製造了像油珠一樣、與人體細胞膜相似的載體,也就是「容器」,將siRNA放入其中。這樣就可以防止siRNA溶於血液,同時,由於這種載體跟細胞膜相似,還能很容易地進入肝星狀細胞。
將siRNA精確送達肝星狀細胞是通過「維生素A」實現的。肝星狀細胞具有吸收並存儲這種維生素的性質。研究人員在載體上加入了維生素A,將這樣的載體釋放到血液中後,會產生RBP(視黃醇結合蛋白)這種複合體。肝星狀細胞上具有識別並吸收RBP的受體,這樣就能使藥物順利聚集到肝星細胞。
如果把siRNA比喻成「裝載的貨物」,那麼載體就是將其運達目的地的「船」,維生素A則是「船頭」。由於眼、脾、肺等也具有吸收維生素A的性質,因此研究人員調整了載體的大小,使其只能通過肝臟的毛細血管。
破壞「設計命令」
被吸收到肝星狀細胞內的siRNA又是如何抑制膠原蛋白合成的呢?這其中利用了「RNA干擾」現象。
在細胞合成構成人體的多種蛋白質時,DNA中所含的基因資訊是不可或缺的,基因可以說是蛋白質的設計圖。儘管如此,蛋白質並非由設計圖直接產生,而是首先將基因資訊特定部分轉錄到與DNA有著相似構造的mRNA中。轉錄到mRNA中的蛋白質設計資訊由細胞中的核糖體讀取,與氨基酸結合,從而形成一個蛋白質。總之,mRNA可以說是製造蛋白質的「設計指導書」。
所謂RNA干擾,是指不讓某種蛋白質過度生成,即siRNA分解某種蛋白質設計指導書mRNA的機制。也可以說,siRNA的作用就是在蛋白質形成之前,識別並破壞其設計指導書。
細胞內具有這種機制,但並不存在抑制肝星狀細胞合成膠原蛋白的siRNA。新津教授的基本思路是,「可以人為製造siRNA,從外部補給」。
DNA、mRNA及siRNA都是由四種核鹼基連接而成的。進入肝細胞內的siRNA與特殊蛋白質融合後,在很多種mRNA中只識別與自己序列相同的mRNA並將其分解。
利用這一機制,便可抑制肝星狀細胞合成膠原蛋白。膠原蛋白由3條蛋白質鏈相互結合而成。利用siRNA分解其中1條蛋白質的設計指導書mRNA即可。
不過,利用這種方法抑制膠原蛋白合成面臨著一大課題。那就是,形成膠原蛋白的蛋白質也有好幾種,即使siRNA破壞了其中一種蛋白質的設計指導書,其他蛋白質3個聚集在一起,仍會合成膠原蛋白。
因此,新津教授關注了起「伴侶」作用的蛋白質HSP47。膠原蛋白的伴侶蛋白HSP47起到幫助3個蛋白質結合成為膠原蛋白的作用。相反,如果在肝星狀細胞內導入對製造HSP47的mRNA進行破壞和分解的siRNA,那麼蛋白質就無法結合,從而使膠原蛋白無法合成。
對老鼠進行的動物實驗結果表明,這種方法非常有效。並且,採用這種方法,不僅抑制了膠原蛋白的分泌,還能使膠原蛋白從纖維化的內臟器官中溶解。也就是說,能夠從根本上治癒肝硬化。
肝臟中還存在分解膠原蛋白的蛋白質分解酶—膠原酶。新津教授認為,如果膠原蛋白停止過度合成,那麼分解膠原蛋白的膠原酶數量就會相對增加,從而可以抑制引起肝硬化的內臟器官的纖維化。

新津教授指出:「這種治療方法的好處是安全性高。不直接作用於基因,只分解HSP47,因此對正常的肝星狀細胞沒有任何影響。」
準備應用於各類纖維症
新津教授之所以與電子產品廠家日東電工合作,是因為日東電工「能夠完全自行生產siRNA、載體、維生素A等新藥要素,還能把這些要素組合起來」。
日東電工希望將在電子產品製造中培育的專業技術應用於各個領域,對該公司而言,醫療是個有望實現增長的領域。因此,該公司在累積技術的同時,一直都在關注該領域尖端研究動向。該公司得知新津教授的研究是在2007年於美國波士頓舉行的學會上。
在製造核酸藥物的工藝材料方面,日東電工已佔有最高佔有率。該公司2008年與新津教授開始合作研究之後,一直在強化業務,比如收購代工生產siRNA等核酸藥物的美國企業等。
而新津教授不僅是研究者,還是現在也到醫療現場為患者治病的臨床醫生。據說新津教授本不是肝硬化方面的專家,但他看到備受該病折磨的患者後,開始研發肝硬化的治療方法。
內臟器官的纖維症不僅發生在肝臟,還會發生在所有部位。其基本症狀和病因跟肝硬化相同,因此,如果新津教授正在研究的治療藥物得以實現,那麼有可能拯救全球4000萬纖維症患者。重視臨床的醫學研究者和日東電工的合作備受期待。(記者:飯山 辰之介,《日經商務》)
科技最趨勢每日精選由日經BP社技術在線網站提供的最新、最專業科技技術報導。
 畫重點
畫重點
 段落筆記
段落筆記


